|
Главная\Документы\Для учителя химии и биологии При использовании материалов этого сайта - АКТИВНАЯ ССЫЛКА и размещение баннера -ОБЯЗАТЕЛЬНО!!!
Разработка урока химии по теме: "Определение качества водопроводной и речной воды". Материал прислала: Новикова Надежда Вячеславовна учитель химии высшей категории МОУ лицей №16 "Естественно-математический" г. Волгодонска Ростовской обл. lyceum-16@mail.ru
Цель: Познакомиться с методиками: - "Определения концентрации ионов трехвалентного железа
- "Определения концентрации ионов хлора
- "Определения концентрации сульфат-ионов.
Задачи: - "Самостоятельно и мотивированно организовать свою познавательную деятельность (от постановки цели до получения оценки и результата)
- "Оценить и корректировать свое поведение в окружающей среде.
- "Выполнять в практической деятельности и в повседневной жизни экологические требования.
Ход урока: I. Вступительное слово учителя. Важность воды: - "Вода, как и воздух, неразделимо связана с существованием жизни на Земле.
- "Большинство процессов в природе протекают с участием воды или в водной среде.
- "Вода необходима для жизни и деятельности человека.
- "Существуют особые требования, предъявляемые к воде.
- "Она должная быть бесцветной, чистой, она должна иметь хороший вкус и не иметь запаха. В ней также не должны содержаться биологические примеси.
II. Повторение методики определения концентрации ионов Fe2+ ,NO31-. Определение концентрации ионов двухвалентного железа. К 5 мл воды добавить на кончике ножа (0,1 г) гидросульфата калия, 0,1 г смеси (красная кровяная соль и сахарная пудра 1:9) и хорошо взболтать. В присутствии ионов двухвалентного железа появляется сине-зеленое окрашивание. Светло-сине-зеленый 1 - 6 мг/л сине-зеленый 6 - 10 мг/л синий 10 - 15 мг/л темно-синий 15 - 30 мг/л Обнаружение нитрат-ионов. К 5 мл воды осторожно, по стенке пробирки, прибавить I мл реактива, полученного растворением I г дифениламина в 100 мл концентрированной серной кислоты. Если есть нитрат-ионы, то появляется синее окрашивание. Но этой реакции мешают нитрит-ионы, которые предварительно надо разрушить. К исследуемой воде добавляют несколько кристаллов хлорида аммония и кипятят 2-3 минуты. Образовавшийся нитрит аммония разрушается до азота и воды. После этого проводят реакцию с дифениламином. III. Объяснение нового материала (демонстрация опытов). Определение концентрации ионов трёхвалентного железа. К 5 мл природной воды прибавить 1-2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданида аммония. В присутствии ионов трехвалентного железа появляется красный цвет. Слабо-красновато-желтоватый 0,95 - 0,4 мг/л желтовато-красный 0,4 - 1,0 мг/л красный 1 - 3 мг/л ярко-красный 3 - 10 мг/л Определение концентрации ионов хлора К 5 мл природной воды прибавить 1-2 капли 10%-ного раствора нитрата серебра, подкисленного азотной кислотой. Образуется осадок или муть. Слабая муть 1 - 10 мг/л сильная муть 10 - 50 мг/л хлопья, осаждаются сразу 50 - 100 мг/л белый объемистый осадок более 100 мг/л Определение концентрации сульфат-ионов К 5 мл воды прибавить 4 капли 10%-ного раствора соляной кислоты и 4 капли 5%-ного раствора хлорида бария. Нагреть. Образуется муть или осадок. слабая муть через несколько минут 1 - 10 мг/л слабая муть сразу 10 - 100 мг/л сильная муть 100 - 500 мг/л большой осадок, быстро оседающий более 500 мг/л IV. Работа с учащимися Во время экспериментальной работы учащиеся самостоятельно заполняют таблицу, с помощью учителя делают выводы. Выводы.
Вода, подаваемая в водопроводную сеть города, соответствует санитарным правилам и нормам. Данные анализа качества воды свидетельствуют о загрязнении Дона: - "тяжелыми металлами;
- "летучими фенолами, нитратами, превышающими ПДК;
- "микробиологическими и вирусологическими показателями.
Важно помнить! - "Питьевая вода должна быть бесцветной, чистой, не иметь запаха и иметь хороший вкус.
- "Она также не должна содержать химических или биологических примесей.
- "Воду надо использовать экономно.
- "Вода - необходимое условие для жизни.
Нужно делать! - "Для сохранения водных богатств создавать замкнутые циклы производства, когда вода используется многократно.
- "Использовать новые биологические методы для очистки воды.
- "Осуществлять постоянный контроль за качеством воды.
V. Домашнее задание: Взять пробу природной воды, определить интенсивность запаха, цветность и мутность. Раздаточный материал Определение интенсивности запаха воды. 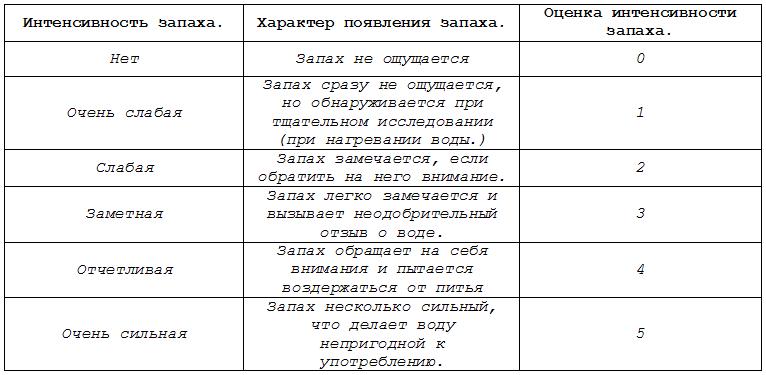 Определения цветности воды: 1.Заполнить пробирку водой до высоты 10-12см. 2.Определите цветность воды, рассматривая пробирку сверху на белом фоне при достаточном боковом освещении (дневном, искусственном.). Подчеркните (или отметить галочкой) наиболее подходящий оттенок из приведенных в таблице либо заполните свободную линию в таблице. Цветность воды. 
Мутность воды. 
Определение концентрации ионов двухвалентного железа. К 5 мл воды добавить на кончике ножа (0,1 г) гидросульфата калия, 0,1 г смеси (красная кровяная соль и сахарная пудра 1:9) и хорошо взболтать. В присутствии ионов двухвалентного железа появляется сине-зеленое окрашивание. - Светло-сине-зеленый ? 1 - 6 мг/л
- сине-зеленый ? 6 - 10 мг/л
- синий ? 10 - 15 мг/л
- темно-синий ? 15 - 30 мг/л
Обнаружение нитрат-ионов К 5 мл воды осторожно, по стенке пробирки, прибавить I мл реактива, полученного растворением I г дифениламина в 100 мл концентрированной серной кислоты. Если есть нитрат-ионы, то появляется синее окрашивание. Но этой реакции мешают нитрит-ионы, которые предварительно надо разрушить. К исследуемой воде добавляют несколько кристаллов хлорида аммония и кипятят 2-3 минуты. Образовавшийся нитрит аммония разрушается до азота и воды. После этого проводят реакцию с дифениламином. Определение концентрации ионов трёхвалентного железа. К 5 мл природной воды прибавить 1-2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданида аммония. В присутствии ионов трехвалентного железа появляется красный цвет. - Слабо-красновато-желтоватый ? 0,95 - 0,4 мг/л
- желтовато-красный ? 0,4 - 1,0 мг/л
- красный ? 1 - 3 мг/л
- ярко-красный ? 3 - 10 мг/л
Определение концентрации ионов хлора К 5 мл природной воды прибавить 1-2 капли 10%-ного раствора нитрата серебра, подкисленного азотной кислотой. Образуется осадок или муть. - Слабая муть ? 1 - 10 мг/л
- сильная муть ? 10 - 50 мг/л
- хлопья, осаждаются сразу ? 50 - 100 мг/л
- белый объемистый осадок ? более 100 мг/л
Определение концентрации сульфат-ионов К 5 мл воды прибавить 4 капли 10%-ного раствора соляной кислоты и 4 капли
5%-ного раствора хлорида бария. Нагреть. Образуется муть или осадок. - - слабая муть через несколько минут ? 1 - 10 мг/л
- - слабая муть сразу ? 10 - 100 мг/л
- - сильная муть ? 100 - 500 мг/л
- - большой осадок, быстро оседающий ? более 500 мг/л
Разработка урока химии по теме: "Определение качества водопроводной и речной воды".
-
| 